October 31, 2024
Navigieren Sie souverän durch 21 CFR Part 11 mit Confience LIMS
Inhaltsverzeichnisliste

Die LIMS-Software (Laboratory Information Management System) ist ein unverzichtbares Instrument zur Einhaltung von Titel 21 CFR Part 11 des Code of Federal Regulations — den Richtlinien der US-amerikanischen Food and Drug Administration (FDA) für elektronische Aufzeichnungen und Signaturen. Da Labore zur Verbesserung der Effizienz ihrer Arbeitsabläufe auf digitale Systeme umsteigen, wird die Einhaltung dieser Vorschriften immer wichtiger. LIMS unterstützen den Übergang von papiergestützten zu computergestützten Systemen, indem sie eine zuverlässige Lösung bieten, die die Integrität, Vertraulichkeit und Genauigkeit elektronischer Daten in jeder Phase ihres Lebenszyklus gewährleistet.
Förderung der Datenintegrität und -sicherheit:
Gemäß der FDA-Vorschrift 21 CFR Part 11 müssen elektronische Aufzeichnungen genauso vertrauenswürdig und zuverlässig sein und im Allgemeinen Papieraufzeichnungen und handschriftlichen Unterschriften auf Papier entsprechen. Die Software für das Laborinformationsmanagementsystem unterstützt Labore dabei, revisionssichere elektronische Aufzeichnungen zu erstellen und zu verwalten, indem sie Benutzerauthentifizierung, Zugriffskontrollen, elektronische Signaturen und umfassende Prüfprotokolle umfasst.
Authentifizierung und Autorisierung:
Die FDA-Verordnung betont die Verwendung elektronischer Signaturen, die für jeden Benutzer einzigartig sind. LIMS enthalten in der Regel strenge Zugriffskontrollen, die Benutzeridentitäten durch sichere Anmeldemechanismen authentifizieren. Durch die entsprechende Konfiguration von Berechtigungen und Rollen in der Software für das Laborinformationsmanagementsystem können Labore sicherstellen, dass nur autorisiertes Personal Zugriff auf vertrauliche Daten und Funktionen hat. Auf diese Weise wird das in 21 CFR Part 11 empfohlene Prinzip der geringsten Rechte eingehalten.
Elektronische Signaturen:
Die Confience LIMS-Software erfüllt mit ihrer Software für elektronische Signaturen die Anforderungen des FDA-Kodex der Bundesvorschriften 21 CFR Part 11 für elektronische Signaturen. Das Modul für elektronische Signaturen bietet zusätzliche Funktionen zur Passwortabfrage für die Validierung, Genehmigung und Zertifizierung von Daten. Es gibt bis zu vier (4) Genehmigungsstufen für elektronische Signaturen, die Benutzer mithilfe einer Matrix für elektronische Signaturen definieren können. Mit dem Modul Elektronische Signaturen kann der Administrator definieren, für welche Transaktionen elektronische Signaturen erforderlich sind, einschließlich:
- Probenidentifikation und/oder Aktualisierung
- Eingabe und/oder Änderung von Ergebnissen
- Eingabe und/oder Genehmigung von Testmethoden
- Eingabe und/oder Genehmigung von Produktspezifikationen
- Zuordnung des Freigabestatus von Proben
Prüfprotokolle:
Umfassende Audit-Trails sind in das LIMS integriert und konfigurierbar, um Datum und Uhrzeit von Eingaben, Änderungen oder Löschungen von Informationen automatisch aufzuzeichnen und den für diese Aktionen verantwortlichen Benutzer zu identifizieren.
Der Audit-Trail zeichnet auf, WAS geändert wurde (das Feld und die Tabelle, die geändert wurden), WANN die Änderung vorgenommen wurde (Uhrzeit und Datum), WER die Änderung vorgenommen hat (der Benutzername der Person, die zum Zeitpunkt der Änderung angemeldet war), WARUM sie geändert wurde, wo immer dies praktisch möglich ist (der Grund für die Änderung) und den VORHERIGEN WERT. Je nach Benutzerkonfiguration können Audit-Trails auf jede der Tabellen in einem LIMS angewendet werden und zeichnen jede Änderung, die an einem oder allen Datensätzen im System vorgenommen wird, Feld für Feld auf.
In den meisten Fällen lassen sich die Informationen zum Audit-Trail am besten anhand eines Berichts darstellen. In einigen Fällen ist es jedoch wünschenswert, den Prüfpfad sofort darzustellen. Audit-Trails werden am häufigsten in Bezug auf die Ergebnisse referenziert, die eingegeben und anschließend mit einem geänderten Wert überschrieben wurden. Wenn ein schneller Zugriff auf Audit-Trail-Aufzeichnungen gewünscht wird, können LIMS-Benutzer mit den entsprechenden Berechtigungen ein Ergebnis oder einen Beispiel-Audit-Trail direkt von der LIMS-Laborsystem-Symbolleiste aus einsehen.
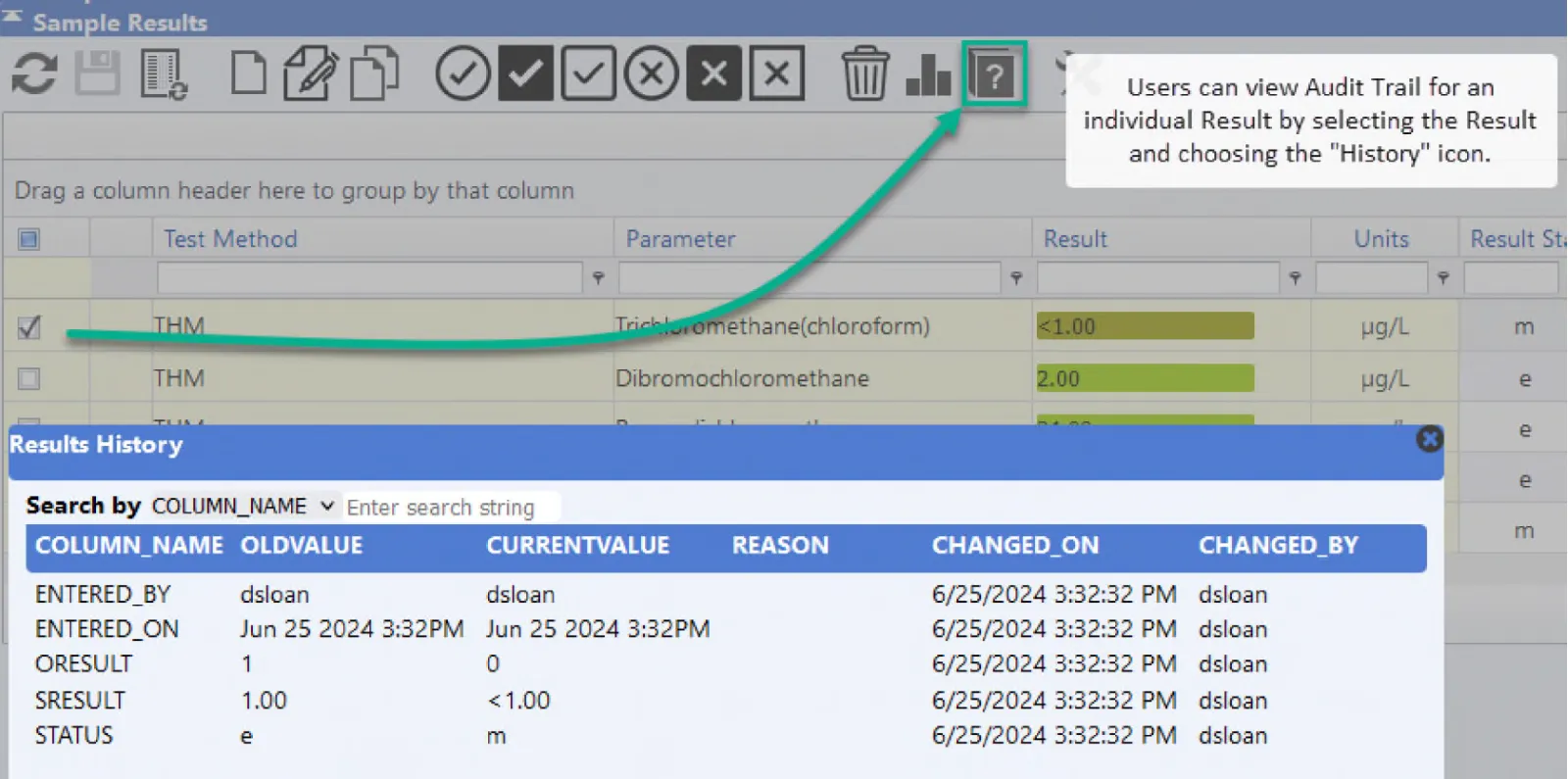
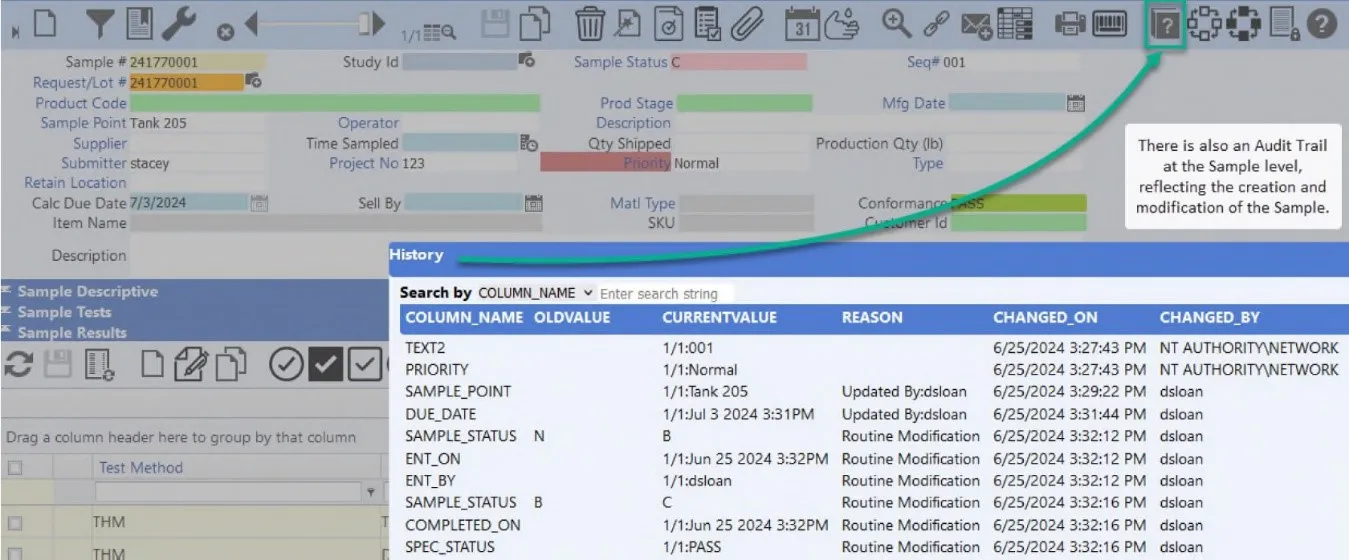
Audit Trails sind äußerst nützliche Tools, da sie es Benutzern ermöglichen, Probleme aufzuspüren, die auftreten können, wenn Daten absichtlich, böswillig oder irrtümlich geändert werden. Die umfassenden Audit-Trail-Funktionen in LIMS fördern nicht nur die Transparenz, sondern sorgen auch für eine unauslöschliche Aufzeichnung, die bei Audits oder Inspektionen von entscheidender Bedeutung ist.
Datensicherung und Speicherung:
Die Gewährleistung der Sicherheit und Wiederherstellung elektronischer Aufzeichnungen ist eine weitere Anforderung der FDA-Verordnung 21 CFR Part 11. LIMS enthalten häufig automatische Datensicherungsfunktionen, und LIMS-Anbieter bieten möglicherweise sichere Datenspeicherlösungen an, die vor Datenverlust schützen und eine einfache Wiederherstellung im Falle eines Systemausfalls ermöglichen. Dies unterstützt nicht nur die Einhaltung gesetzlicher Vorschriften, sondern erhöht auch die allgemeine Widerstandsfähigkeit des Laborbetriebs.
Systemvalidierung:
Um für den Einsatz in regulierten Branchen geeignet zu sein, muss der Betrieb des Systems validiert werden. Die Validierung von Systemen zur Sicherstellung der Genauigkeit, Zuverlässigkeit und gleichbleibend beabsichtigten Leistung ist in stark regulierten Umgebungen ein entscheidender Schritt, um die Datenintegrität sicherzustellen und die Einhaltung der Vorschriften nachzuweisen. LIMS-Anbieter können Validierungsdienste und Dokumentation als Option für Unternehmen anbieten, in denen dies erforderlich ist, um sicherzustellen, dass das System den festgelegten Anforderungen entspricht und die vorgesehenen Aufgaben bewältigen kann. Dies kann zeitaufwändig und kostspielig sein. Daher müssen Unternehmen in regulierten Umgebungen vor Beginn des Prozesses festlegen, wie gründlich ihre LIMS-Validierung sein muss.
Zu den Schritten zur LIMS-Validierung können gehören: 1) Entwicklung einer Benutzeranforderungsspezifikation (URS) und einer passenden Funktionsspezifikation (FS), 2) Risikobewertung, 3) Installationsqualifizierung (IQ), 4) Betriebsqualifizierung (OQ) und 5) Leistungsqualifizierung (PQ). Der Nachweis der Validierung muss sorgfältig dokumentiert werden, um den Anforderungen der Aufsichtsbehörden gerecht zu werden.
Fazit:
Zusammenfassend lässt sich sagen, dass LIMS unverzichtbare Tools für Labore sind, die 21 CFR Part 11 einhalten wollen. LIMS bietet ausgefeilte Funktionen für Benutzerauthentifizierung, elektronische Signaturen, Prüfprotokolle, Datenarchivierung und Systemvalidierung und hilft Laboratorien dabei, die strengen Standards der FDA für elektronische Dokumentation und Aufzeichnungen zu erfüllen. Angesichts der Weiterentwicklung der regulatorischen Anforderungen und des technologischen Fortschritts werden kontinuierliche Upgrades und Verbesserungen von LIMS von entscheidender Bedeutung sein, um die Einhaltung der Vorschriften zu gewährleisten und die Integrität und Sicherheit der LIMS-Laborsysteme zu gewährleisten.
Confience offers an automatisiertes Labormanagement and data integrity for vertrauenswürdige produkte. Möchten Sie mehr über Confience erfahren? Fordere eine Demo an unter www.confience.io.
Erstklassiges LIMS, entwickelt für Ihren Erfolg
Sehen Sie, was Confience anders macht. Sprechen Sie mit einem Mitglied unseres Teams.
Vereinbaren Sie eine Demo




.webp)


